学术前沿
非遗传性的晚发型阿尔茨海默病(LOAD)是最常见的AD形式,占全部AD病例的95%以上,但目前,我们仍然没有LOAD特异性疾病模型。AD的关键神经元特征包括细胞外的β淀粉样蛋白(Aβ)斑块沉积、细胞内的神经原纤维缠结和神经元丢失,对这些病理特征的建模很大程度上依赖于携带常染色体显性AD(ADAD)致病基因的细胞和动物。
干细胞和重编程技术使得疾病建模发生了飞跃的进展,但是重编程后的诱导性多能干细胞(iPSC)会将供体细胞的年龄特征重置到胎儿阶段,这对于年龄相关疾病的建模并不算是一个好消息,例如,来自AD患者的iPSC衍生的神经元能够表现出Aβ42、活性GSK-3β、磷酸化tau、核内体异常和氧化应激,但晚期神经病理学特征,包括不溶性tau形成和神经退行性病变尚未得到呈现。
直接细胞重编程可以保留非神经体细胞中的衰老特征,如表观遗传年龄、端粒长度和基因表达变化。
华盛顿大学医学院的研究团队开发了一种基于小分子RNA(miRNA)的直接重编程方法,使用miR-9/9*和miR-124对LOAD患者的成纤维细胞进行重编程,衍生而来的神经元可以呈现出Aβ和tau的沉积,以及年龄相关转座子失调特征。他们还发现,抑制反转座子失调可以挽救神经退行性变和减少Aβ沉积。
研究结果发表在今天的《科学》杂志上[1]。这是首次成功地让干细胞衍生的神经元表现出AD的关键特征,包括Aβ的形成、tau的沉积和神经元的死亡[2]。

研究人员从10名AD患者(4名ADAD和6名LOAD)和17名年龄、性别相匹配的健康对照中收集了成纤维细胞,使用miR-9/9*和miR-124,以及转录因子NEUROD2和MYT1L进行重编程,衍生出了高度富集的神经元。他们设计了两种3D培养方法:薄凝胶培养和高细胞密度组装球形结构,前者可以对单个神经元进行形态学分析,后者简称为球状体。
培养出的单个神经元和球状体都表达标准的成熟神经元标志物,不表达星形胶质细胞、小胶质细胞和少突胶质细胞等非神经元标志物。
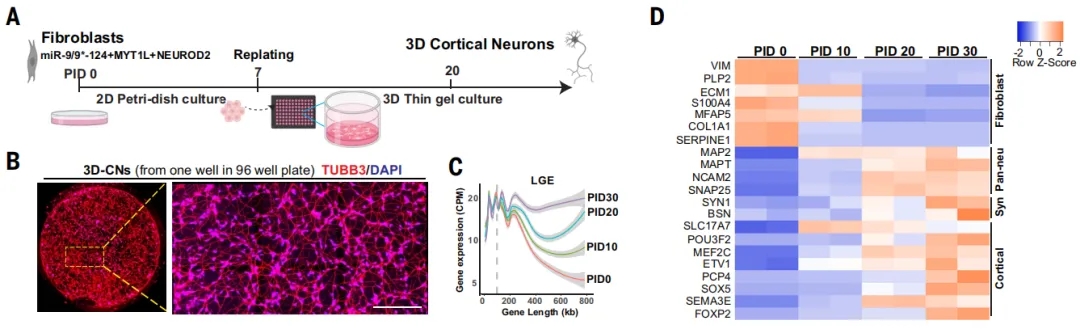
LOAD来源的神经元表达神经元标志物
ADAD的发病是由基因突变直接驱动的,因此,研究人员首先检测了携带PSEN1或APP突变的ADAD患者来源的重编程神经元,在单个神经元和球状体中,检测到Aβ的沉积和Aβ依赖性的tau病理,并且表现出自发性神经退行性变。
由于在ADAD中的成功,研究人员接下来着手验证LOAD患者来源的重编程神经元是否同样具有AD的特征。
在22岁的年轻健康人来源的单个神经元中,Aβ沉积很少,但随年龄的增长逐渐变得明显。来自60-89岁的LOAD患者来源的单个神经元中,Aβ沉积相比年龄匹配的对照更高,球状体也有类似的现象。
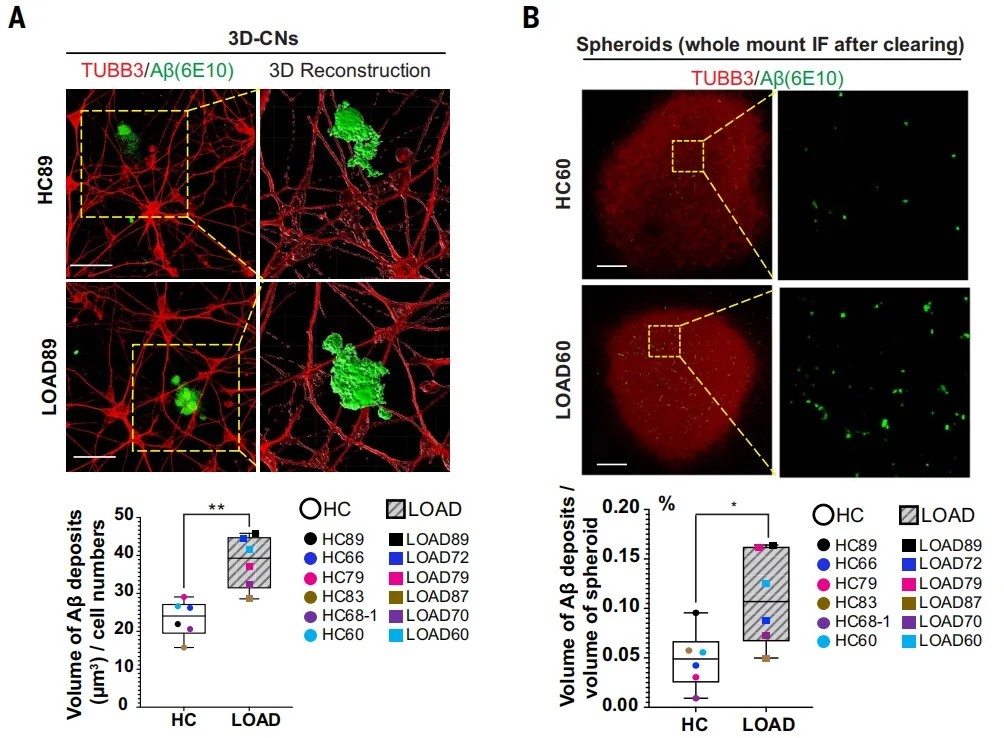
单个神经元和球状体中的Aβ沉积
在tau病理方面,LOAD来源的神经元与健康对照相比,3R和4R tau的比值没有显著差异,这与AD是一种混合的3R/4R tau蛋白病的概念相一致。LOAD来源的神经元的tau磷酸化水平随着年龄的增长而增加,且显著高于健康对照。此外,LOAD来源的神经元还具有更高水平的MC1 tau抗体,它可以识别构象异常的tau。
在营养不良神经突位置,LOAD来源的神经元表现出K63-泛素阳性致病性tau信号升高和具有播种能力的tau。
在有Aβ和tau病理的“加持”下,LOAD来源的单个神经元和球状体都观察到了自发性神经退行性变和突触形成的损伤。
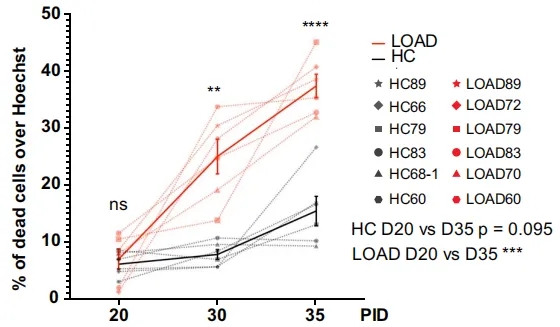
LOAD来源的神经元死亡更多
LOAD来源的神经元的转录组分析显示出832个差异表达基因,基因功能注释表明,炎症、AD和认知障碍是差异表达基因相关的主要“词条”,基因表达增加的主要为炎症和免疫反应相关途径,下降的主要为核小体组装、端粒和记忆相关。
此前有研究显示,在衰老过程中,反转录转座子(RTE)的失调可能会触发炎症反应,果蝇研究也发现抑制RTE降低了tau激活和诱导的神经毒性,因此,研究人员进行了检测,他们发现,重编程的球状体中也有年龄依赖性的RTE表达变化,反转录酶抑制剂拉米夫定破坏LOAD神经元中的RTE失调,导致Aβ、tau病理、神经元死亡和DNA损伤减少,并且与炎症相关基因的表达变化相关。
综上所述,这项研究验证了miRNA诱导的LOAD神经元在模拟AD神经病理学的可行性。这些神经元为了解衰老如何影响LOAD患者神经退行性变提供了平台。
研究人员指出,未来的研究目标应该是确定与AD发病机制有关的其他衰老机制,与神经元中AD风险基因表达相关的机制,以及可能影响患者来源神经元中AD病理特征与其他脑类型细胞的相互作用。
参考文献:
[1] https://www.science.org/doi/10.1126/science.adl2992
[2] https://medicine.wustl.edu/news/aging-related-genomic-culprit-found-in-alzheimers-disease/