1924年,德国生理学家Otto Warburg发现,与正常细胞相比,癌细胞的生长非常依赖糖酵解,这个过程会产生大量的“代谢废物”,乳酸。
癌细胞明明需要大量的能量消耗,为什么会放弃氧化磷酸化,反而选择糖酵解呢?这个被我们称作Warburg效应的现象至今都是未能完全解开的谜团。
当然我们现在知道,癌细胞并不傻,糖酵解实际上能过够为癌细胞的生长壮大提供非常多的方便,比如说糖酵解营造的酸性环境会有助于癌细胞逃避免疫系统的追杀;乳酸可以通过表观遗传修饰促进巨噬细胞向抗炎、促癌的M2型转变;糖酵解的过程还与促进癌细胞的增殖转移有关。
由此来看,癌细胞选择糖酵解可谓以小博大,真是毫不吃亏。
近期,发表在《自然》杂志上的一篇论文又发现了癌细胞的新花招。原来,调节T细胞(Treg)的功能受代谢影响很大,Treg会通过摄取乳酸来避免高葡萄糖环境对功能的损害。也就是说,在癌细胞营造的高乳酸环境中,效应T细胞被抑制的时候,Treg的功能仍可正常发挥,由此削弱了抗肿瘤免疫[1]。
有意思的是,这种机制很有可能为免疫治疗的应用增加空间。
癌细胞选择糖酵解,绝对另有图谋。
此前科学家们已经发现,肿瘤的代谢重编程与效应T细胞的功能下降有关。抗癌先锋受到粮草限制,那么免疫天平的另一端,抑制免疫的Treg功能是否也会受到糖酵解的影响呢?
研究者从糖酵解增强的肿瘤模式小鼠中收集了Treg,发现如同预期,Treg在肿瘤中富集,功能上并没有受到代谢的抑制,反而表现出活跃的增殖状态。实际上,研究者用荧光示踪剂追踪了它们对葡萄糖的摄取,发现Treg摄取葡萄糖显著减少了。
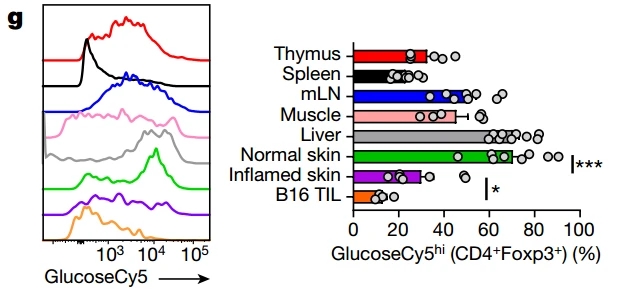
进一步分析不同组织中的Treg,研究者发现了一个奇怪的现象,来自不同组织的Treg对葡萄糖的偏好差异非常大,来自B16黑色素瘤和炎症皮肤组织中的Treg明显更不喜欢糖。而传统T细胞对糖的偏好就没这么大区别。
不同组织的Treg葡萄糖摄取量差异极大
那么,对葡萄糖偏好不同的Treg,在功能上是否有区别呢?
研究者分别纯化的低偏好和高偏好的Treg,并对功能进行了测量。不考虑它们来源的组织,对糖偏好高的Treg,在免疫抑制上的能力显著低于低偏好的Treg。这在动物研究中也得到了证实。
可以认为,Treg对糖的偏好与免疫抑制能力差有关。
进一步分析这两个不同Treg群体的基因表达,研究者发现低偏好Treg表现出了丰富的糖酵解酶表达,尤其是Ldha编码的乳酸脱氢酶和一种介导乳酸摄取的单羧酸转运体MCT1。
很显然,这些Treg放弃了对葡萄糖的喜爱,转向了糖酵解产生的乳酸。
可见糖偏好不同的Treg基因表达差异极大
我们知道,在高糖酵解的肿瘤中,肿瘤微环境里含有大量乳酸,这已被证实具有免疫抑制作用。不过这里抑制的主要是那些起到抗肿瘤作用的T细胞,比如说效应T细胞。相对的,Treg不仅在高乳酸环境中悠然自得,甚至还能够吸收利用乳酸,表现得活力非常。
有意思的是,高糖环境会抑制Treg的功能,但是当研究者向环境中添加相当于肿瘤微环境水平的乳酸的时候,Treg功能得到了恢复。
由此来看,Treg选择乳酸,更像是一种对有害环境的自我保护,而这种机制,就恰好被肿瘤利用来发展自身了!
研究者尝试条件敲除了小鼠Treg中的MCT1,阻止Treg摄取乳酸。接种B16黑色素瘤的小鼠肿瘤生长显著减缓,生存期也延长了。这也同样减缓了MC38乳腺癌和MEER头颈部鳞状细胞癌的生长。
通过药物触发MCT1缺失,再结合抗PD-1治疗,37.5%的B16小鼠肿瘤完全消退——这种肿瘤一般来说对免疫治疗是不敏感的。
阻断Treg对乳酸的摄取大幅度增加了B16小鼠的生存
同期发表的另一篇研究[2]也独立发现了CTLA-4阻断治疗与Treg糖代谢之间的复杂关系,之后奇点糕会另行进行解读。由这两项研究来看,抗糖酵解和免疫治疗或许能够成为一对好帮手。