供稿:梁轩,北京大学
大家好,今天为大家介绍一篇ACS Chem. Biol.的文章“Inhibiting HTLV-1 Protease: A Viable Antiviral Target”,通讯作者是美国麻省大学医学院的Celia A. Schiffer教授。在这篇文章中,作者利用HTLV-1蛋白酶和HIV-1蛋白酶的结构相似性,从HIV-1蛋白酶抑制剂darunavir(图1)出发,设计了能够高效抑制HTLV-1蛋白酶的darunavir类似物,并分析其抑制作用的结构基础。
人类嗜T细胞病毒(HTLV)可以分为1型和2型(HTLV-1/2),是第一个被发现的人类逆转录病毒。HTLV-1具有较强的致癌性和感染性,能够引发神经系统和免疫系统的紊乱。但目前为止,还没有上市能与其直接作用的抗病毒药物。HTLV-1的成熟机制与HIV-1类似,需要HTLV-1蛋白酶的切割和加工。HTLV-1 蛋白酶是一种天冬氨酸水解酶,分子量为28 kDa,其活性中心的残基与HIV-1蛋白酶具由45%的相似性。
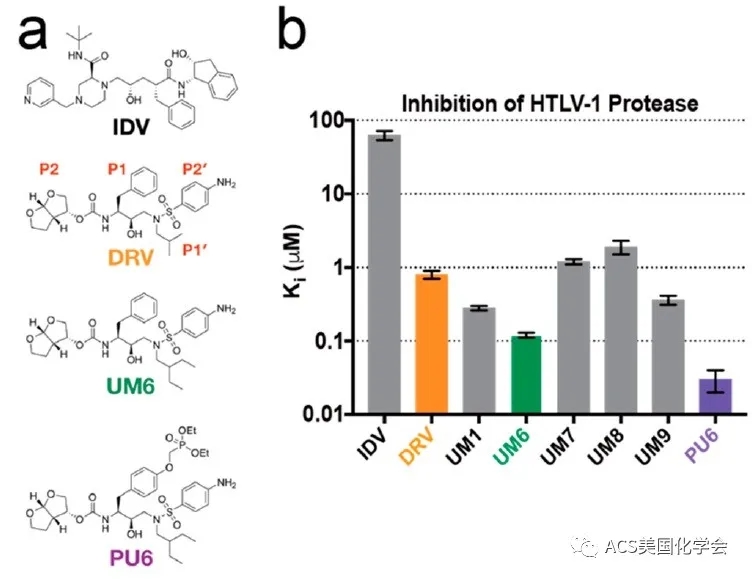
图1. Darunavir及其类似物对HTLV-1蛋白酶的抑制作用
先前的研究表明:已经被FDA批准的、针对HIV-1蛋白酶的抑制剂darunavir(达芦那韦,DRV)对于HTLV-1蛋白酶也有一定的抑制作用。作者因此考虑从darunavir出发,对darunavir的P1′等位置进行了修饰改造,设计了几种darunavir的类似物,并研究了它们对HTLV-1蛋白酶的抑制作用。作者首先利用基于FRET的酶活测试,分析了DRV和多种底物对HTLV-1蛋白酶的抑制作用,发现有几个类似物具有更好的抑制作用,其中UM6的Ki 达到了0.12 μM左右,相比于darunavir低了7倍。作者又在UM6上增加了一个磷酸二乙酯基团得到了PU6,PU6显示出了更强的抑制酶活效果,其Ki 达到了0.03 μM左右。
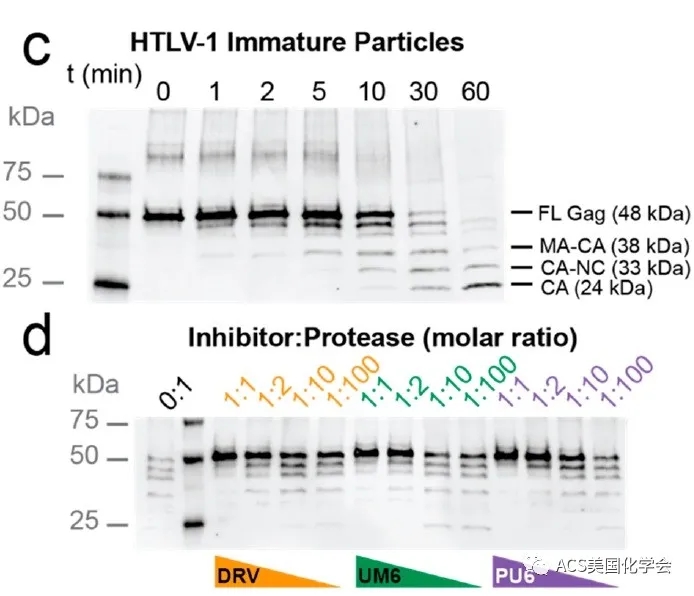
图2. Darunavir及其类似物能够抑制Gag蛋白的加工过程
HTLV-1的成熟离不开Gag的正确切割与加工,因而作者考察了darunavir及类似物对该过程的影响,通过SDS-PAGE等方法证明:DRV、UM6和PM6都能够抑制Gag的切割加工,并且抑制效果具有剂量依赖性(图2),这表明这些抑制剂能够通过抑制HTLV-1蛋白酶来影响病毒的成熟过程。

图3. DRV、UM6和PM6与HTLV-1蛋白酶的结合结构图
为了阐明这些分子的抑制机理,作者测定了HTLV-1蛋白酶分别与DRV、UM6和PM6形成的复合物晶体结构。作者发现DRV中部的羟基能与酶的天冬氨酸催化残基产生相互作用,但由于该分子较小无法形成很好的结合效果。而UM6和PM6在P1′位置具有更大的异己基,能够更好地填充S1′空腔,使得抑制剂与酶分子之间产生更强的疏水作用力,从而赋予了两个类似物比darunavir更强的抑制力。除此之外,PM6上引入的磷酸二乙酯基团则能够延伸到蛋白酶的S1通道,与Leu57, Trp98′和Arg10′等残基形成范德华作用力,使得PM6的抑制作用进一步增强(图3)。进一步的分子动力学模拟表明,蛋白的Ala59/59′ 和Trp98/98′ 残基具有很强的灵活性,如果能够对分子进一步修饰来稳定这些残基将有助于进一步增强抑制剂对酶的抑制作用。
总体来说,这篇文章利用HIV-1蛋白酶和 HTLV-1蛋白酶的结构相似性,对HIV-1蛋白酶抑制剂darunavir进行改造,开发了能很好抑制HTLV-1蛋白酶活性的小分子,并分析了抑制作用的结构基础,为开发靶向HTLV-1的抗病毒药物提供了很好的思路。
扫描二维码阅读英文原文

ACS Chem. Biol. 2021, ASAP
Publication Date: February 23, 2021
https://doi.org/10.1021/acschembio.0c00975
Copyright © 2021 American Chemical Society



