来源:MedSci梅斯 ,作者Dr. Du 发布日期:2020-12-25 20:32:00 浏览:次
本文转载自“MedSci梅斯 ”微信公众号。
2020年接近尾声,2021年即将到来。在过去的一年中,新冠大流行背景下癌症领域仍有诸多突破性研究。为此,根据最新发布的2020癌症负担报告,梅斯医学特地给大家选取盘点了各大常见癌症的进展和研究。So, everybody, enjoy~
近日,2020年全球最新癌症负担报告由世界卫生组织下属国际癌症研究机构(IARC)发布,报告对2020年度全球常见的癌症类型、导致死亡主要癌症类型以及未来的癌症发展趋势进行了全面的分析。数据显示,2020年新发各类癌症共计1930万例,死亡近1000万例。几乎每5人中就有1人在一生中会罹患癌症,而每8名男性、每11名女性中即有1人因癌症而死亡。
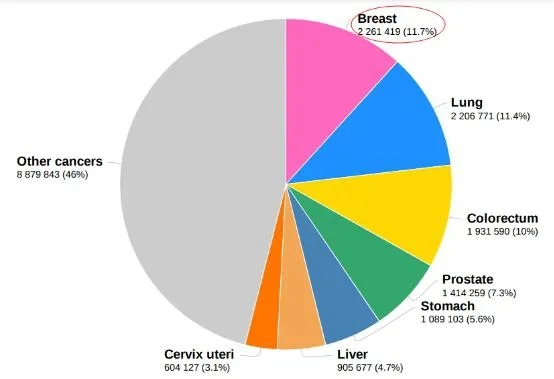
2020年全球最常见新发癌症类型及占比. https://www.iarc.fr/faq/latest-global-cancer-data-2020-qa/
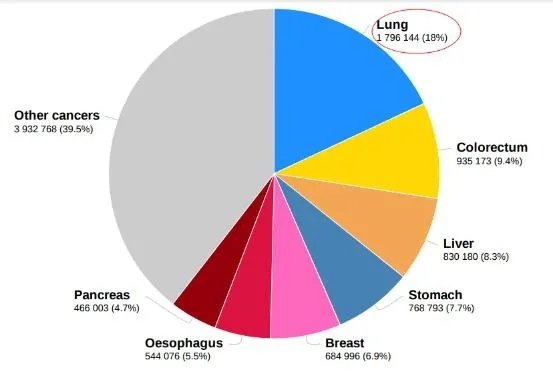
其中,乳腺癌首次超过肺癌,成为全球最常见癌症,约占新发癌症病例的11.7%。其次分别是肺癌、结直肠癌、前列腺癌、胃癌、肝癌、宫颈癌、食管癌、甲状腺癌和膀胱癌,上述十种最常见癌症类型占据新发癌症病例60.1%。但值得注意的是,肺癌仍为导致癌症死亡的首要原因,约占死亡人数的18%。且包括肺癌在内的最常见致死十大癌症(包括结直肠癌、肝癌、胃癌、女性乳腺癌、食管癌、胰腺癌、前列腺癌、宫颈癌和白血病)导致的死亡占癌症总死亡人数70.8%。
2020年全球最常见癌症死亡及占比. https://www.iarc.fr/faq/latest-global-cancer-data-2020-qa/
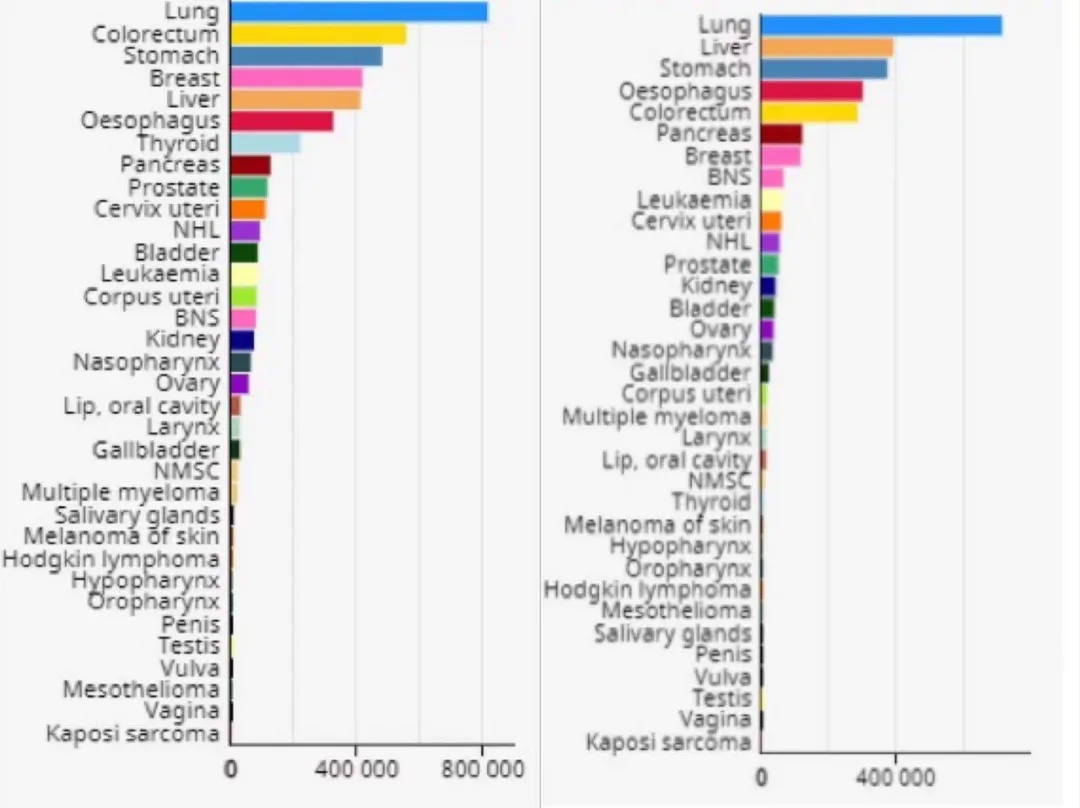
2020年我国最常见癌症及癌症死亡占比. https://www.iarc.fr/faq/latest-global-cancer-data-2020-qa/
下面,我们就对上述最常见肿瘤相关领域的最新进展进行回顾。
1、Nature:谷歌AI系统筛查乳腺癌的国际评估
在临床肿瘤领域,乳腺钼靶筛查是预防筛查乳腺癌的常规方法,目的是在疾病早期阶段及时识别乳腺癌,这是成功治疗乳腺癌,甚至治愈疾病的基本前提。尽管全世界都有筛查程序,但对乳房X线照片的解释仍受到较高的假阳性和假阴性的影响。
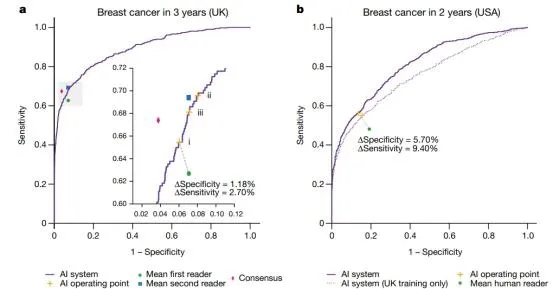
今年1月,Nature上发表了一篇研究文章,来自谷歌等机构的研究人员合力开发了一种人工智能(AI)系统,该系统能够在乳腺癌预测方面超越人类医学专家。为了评估其在临床环境中的性能,研究人员选择了来自英国的大型代表性数据集和来自美国的大型数据集。
研究人员发现假阳性率降低了5.7%和1.2%(美国和英国),假阴性率降低了9.4%和2.7%。研究人员提供了该系统从英国推广到美国的证据。在对六位放射科医生的独立研究中,AI系统的表现优于所有人类医学读者:人工智能系统在受试者工作特性曲线下的面积(AUC-ROC)比一般影像学医师的AUC-ROC要大,绝对幅度达11.5%。研究人员进行了模拟,其中AI系统参与了在英国使用的双重阅读程序,结果发现AI系统保持了不逊色的性能,并将阅片医师的工作量减少了88%。
AI和放射医生在乳腺癌预测中的表现。doi: 10.1038/s41586-019-1799-6.
由此可见,AI系统的强大评估能力为临床试验铺平了道路,以提高乳腺癌筛查的准确性和效率。
2、NEJM:ADAURA研究奥希替尼显著改善NSCLC伴EGFR突变患者无病生存期
第三代EGFR-TKI奥希替尼是临床中治疗EGFR突变阳性晚期非小细胞肺癌(NSCLC)患者的一线治疗方案,ADAURA研究将奥希替尼的角色转移到术后辅助治疗,为奥希替尼增添了更多的临床角色,更多患者从中获益。
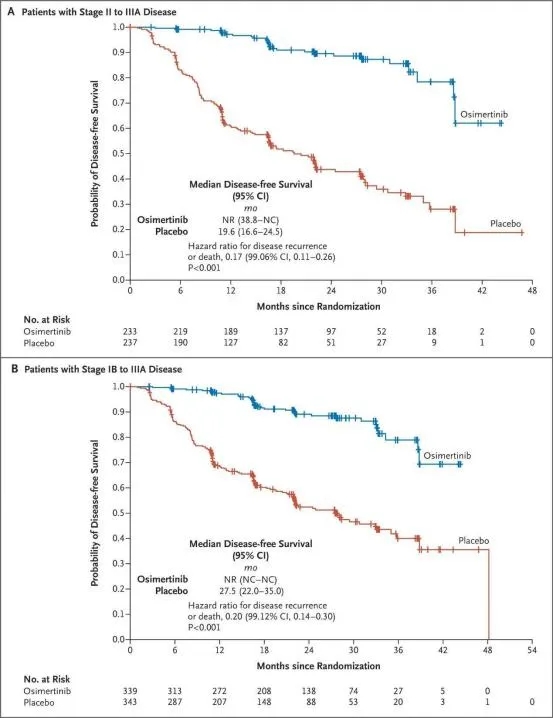
今年9月20日,ADAURA研究的分析结果以Late Breaking Abstracts(LBA)形式在2020 ESMO年会公布,该研究的全文也正式在NEJM同步在线发表,该研究结果引起全球肺癌领域专家的关注。ADAURA研究是首个在全球范围内开展的EGFR TKIs对比安慰剂辅助治疗的3期临床研究,也是首个三代EGFR TKI辅助治疗的大样本研究。研究入组了682例完全切除术后的IB-IIIA EGFR突变阳性NSCLC患者,无论接受辅助化疗与否都可以入组,分别接受奥希替尼(339例)和安慰剂(343例),主要终点为II-IIIA期患者的DFS。次要终点为IB-IIIA期患者的DFS、OS和安全性。基于奥希替尼突破性的疗效,研究结果提前揭盲并在2020年ASCO年会上首次报告初步结果。
结果显示,II–IIIA期患者2年DFS分别为90%和44%(HR=0.17);在总人群中,2年DFS分别为89%和52%(HR=0.20)。2年时,奥希替尼组和安慰剂组分别有98%和85%的患者仍然存活,且未出现中枢神经系统(CNS)转移(HR=0.18)。在药物安全性方面也获得了和奥希替尼以往研究一致的数据,≥3级的不良事件较其他TKI略低。
结果显示IB期患者2年DFS率分别为88% vs. 71%(HR=0.39),II期患者分别为91% vs. 56%(HR=0.17),IIIA期患者分别为88% vs. 32%(HR=0.12)。这些数据证实2年DFS率在IB、II和IIIA期是一致的,这也使得ADAURA成为全球第一个在IB-IIIA期NSCLC患者中都有DFS显著获益的临床研究,进一步扩大了TKI辅助治疗的适用人群。
ADAURA研究DFS数据。DOI: 10.1056/NEJMoa2027071
亚组分析显示,奥希替尼辅助治疗可以为不同特征患者带来DFS的显著获益。所有分期患者均有显著的DFS获益,其中IIIA期患者的获益最为显著,DFS HR为0.12。无论是否使用过辅助化疗,均能从后续辅助奥希替尼中获益,其中既往接受过辅助化疗的患者获益更为显著,DFS HR达到0.16。
两组中,45例患者出现CNS相关疾病复发或死亡(奥希替尼组2%(6/339),安慰剂组11%(39/343))。CNS复发两组分别为4例(1%)和33例(10%)。在2年时,奥希替尼组和安慰剂组分别有98%和85%的患者仍然存活且未出现CNS转移,奥希替尼降低了82%的脑转移或死亡风险,奥希替尼组的CNS中位DFS尚未达到,而安慰剂组CNS中位DFS为48.2个月。这一结果无疑给奥希替尼辅助治疗在临床应用的优势进一步增加了砝码。
因此,在临床实践中,II-IIIA期EGFR突变患者在术后接受奥西替尼治疗可显著延长患者的无病生存期,推荐作为辅助治疗的方案。相信随着ADAURA的成功,全球将开启EGFR TKI辅助治疗的全新时代。
3、NATURE双重磅: 肠道菌群紊乱或能引起结直肠癌?可能与p53有关!
8月28日,美国《复仇者联盟》系列电影饰演“黑豹”的好莱坞演员查德维克·博斯曼,因罹患结肠癌在洛杉矶家中去世,终年43岁。在为博斯曼惋惜的同时,大家更要警惕结直肠癌这类恶性肿瘤。
结直肠癌(CRC)是最常见的恶性肿瘤之一,其发病率居于全球恶性肿瘤第3位,死亡率高居第2位,是占全球发病和死亡首位的消化系统恶性肿瘤。在我国,CRC发病率呈逐渐上升趋势,2018年,我国新发病例占全球同期的30%。更重要的是,目前我国CRC5年生存率远低于美国及日韩,85%以上的病例发现时已是晚期。
而在人类肠道中,居住着大约10万亿个细菌,它们能影响消化功能、抵御感染和自体免疫疾病的患病风险。健康人的肠道菌群中大部分是有益菌,而肠癌患者的有益菌比例可低至10%左右。近年来,有关肠道菌群生理功能和病理地位的研究越来越多,已经证明肠道菌在结肠炎的发生和发展过程中发挥重要作用,而结肠炎是大肠癌的重要危险因素。
那么,近年来被研究的如火如荼的肠道菌群是否与CRC的发生有关呢?今年年初,发表在Nature上来自荷兰胡布勒支研究所(KNAW)Hans Clevers研究团队的研究或许能给出答案。
健康人肠道与基因毒性大肠杆菌共培养诱导DNA损伤。doi: 10.1038/s41586-020-2080-8.
研究人员怀疑一种名为 pks+ E. coli 的大肠杆菌是结肠癌诱因之一。这是一种能分泌大肠杆菌素的大肠杆菌菌株,因为这种菌株在结直肠癌患者的粪便样本中较健康人的更常见。克拉弗斯和他的团队用了5个多月的时间,在一个培养皿内将 pks + E. coli 菌株注射进了被称为类器官的小型人体细胞团中。他们发现,这种微生物触发了一种独特的DNA损伤模式(碱基序列发生了错义突变)。
大肠杆菌素和类似基因毒素以一种特定的突变模式破坏人类DNA,与烟草烟雾、紫外线等致癌物质相同。该研究小组随后核对了两项前人的研究,在这两项研究中,近6000个肿瘤(主要来自结肠)的基因被测序,结果显示,其中5%~10%的结肠癌有着相同的突变模式,但在其他肿瘤中没有发现这个现象。
Clevers说:“我们认为这是非常有力的证据,证明的确是这些细菌导致人们患上癌症。”如果得到证实,人们就可以用抗生素清除这种致癌细菌,并服用有益健康的大肠杆菌的益生菌胶囊,以阻止有害的大肠杆菌再次出现。
随后,在7月份的Nature杂志上,来自以色列希伯来大学的研究团队发现,与癌症密切相关的突变型p53在远端肠道中具有致癌作用,而在近端肠道(如小肠)中却显示出明显的抑癌作用。P53不同的作用或与肠道菌群有关。
研究人员使用抗生素来杀死小鼠结肠中的肠道微生物,结果发现,在引入突变型p53的小鼠肿瘤模型中,使用抗生素后,结肠和回肠中观察到的发育不良消失了,WNT的激活减少了,而且肠道的健康状态也变得更好了。
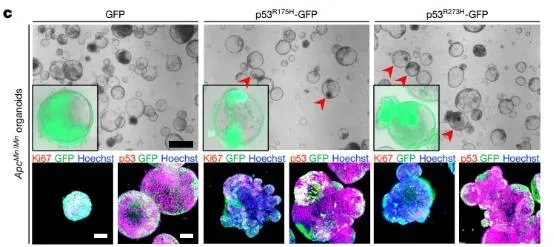 p53突变促进肠道肿瘤器官生长和分化。doi: 10.1038/s41586-020-2541-0.
p53突变促进肠道肿瘤器官生长和分化。doi: 10.1038/s41586-020-2541-0.
4、Science:“癌中之王”—胰腺癌似乎迎来了治疗曙光!
随着精准医学的发展,癌症患者的整体生存率已普遍提高,但有个例外,那就是胰腺癌。绝大部分胰腺癌患者在确诊半年内死亡,是所有癌症中生存率最差、死亡率最高的,被称为“癌中之王”,美国临床肿瘤学会(ASCO)前主席、著名肿瘤专家George Sledge博士将癌症分为两种:一种是由单一异常信号通路驱动的“愚蠢癌”,另一种是有多种方法可刺激同一通路的“聪明癌”,而胰腺癌就属于“聪明癌”,而且聪明绝顶。
近年来关于胰腺癌的研究层出不穷,从胰腺癌早期筛查到药物联用,而从新机理出发有效活用目前现有药物的研究却少之又少,哥伦比亚大学欧文医学研究中心的科学家于Science杂志发表了相关研究,使用一种另类方式试图“饿死癌细胞”。
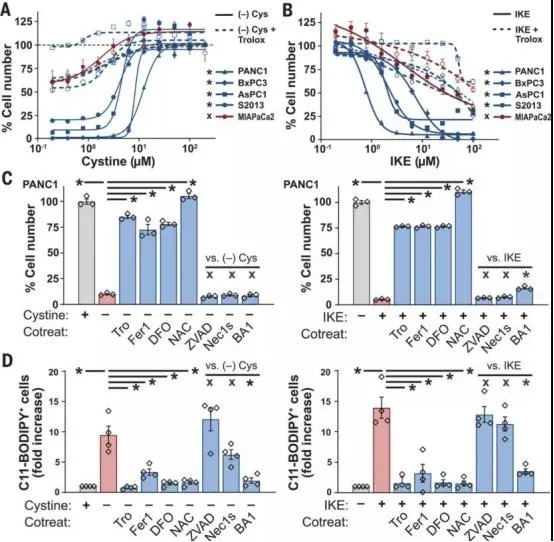
胰腺癌细胞需要半胱氨酸来避免铁凋亡。DOI: 10.1126/science.aaw9872
来自哥伦比亚大学欧文医学中心和赫伯特欧文综合癌症中心的研究表明,一种罕见肾结石疾病的化合物可能具有抗胰腺癌的潜力。该化合物能使肿瘤缺少一种必需氨基酸--半胱氨酸,而半胱氨酸对胰腺癌细胞的存活至关重要。
大多数胰腺肿瘤都会增加过氧化物的产生,从而杀死许多正常细胞。然而,在这些过氧化物增加的有毒的条件下,胰腺肿瘤通过吸收大量的半胱氨酸而在这种毒性环境下茁壮成长。想要消解有毒过氧化物,包括胰腺肿瘤细胞在内的所有细胞都必须使用半胱氨酸。
由于胰腺肿瘤的生存似乎依赖于半胱氨酸的输入,因此,研究作者、哥伦比亚大学瓦杰洛斯内科和外科医学院副教授Kenneth P. Olive及其同事推测,通过选择性靶向这种氨基酸可能会减缓肿瘤的生长。
在动物实验中,当控制半胱氨酸生成的基因在与人类肿瘤非常相似的胰腺癌小鼠中被敲除从而切断了肿瘤的半胱氨酸供应后,肿瘤就停止生长,小鼠中位生存期增加了一倍。研究人员用半胱氨酸酶(一种能分解血液中半胱氨酸的实验药物)治疗小鼠,取得了类似的结果。
这项新研究最令人兴奋的一点是,半胱氨酸的消耗似乎不会损害健康的正常细胞。可以想象,身体里的所有细胞对每种氨基酸的需求都是一样的,但是我们从之前的研究中知道,大多数正常细胞只需要非常低水平的半胱氨酸。针对正常细胞和癌细胞之间的这种差异,研究出一种对癌症有毒、对身体其他部位无害的治疗方法,这或许并不是梦。
5、NEJM:“老药”阿司匹林再出新技能——预防肝癌发生
阿司匹林好像无所不能,以至于很多人打趣说:如果有一天被困在荒岛上,并且随身只能携带一种药物,那一定会选阿司匹林。这是因为它可以退热、止痛、抗炎、预防血栓……甚至还能预防癌症。
去年3月份,中国学者的研究成果再一次巩固了阿司匹林的“神药”地位。台北荣民总医院的Wu Chunying博士和其研究团队在JAMA子刊上发表文章,他们发现,服用阿司匹林与慢性乙型肝炎患者的肝癌发生风险降低29%有关。而今年3月,发表在NEJM的另一篇研究直接指出长期少量服用阿司匹林可降低肝癌风险。
由乙型或丙型肝炎病毒引起的肝脏感染,是肝癌最常见的危险因素。由瑞典卡罗林斯卡学院和美国马萨诸塞州总医院研究人员组成的研究小组分析了13,276名乙肝患者和36,999名丙肝患者,一共50,275名无阿司匹林使用史的成年参与者的信息。这些参与者中,14205人(2998例乙肝和11207例丙肝)在研究期间开始服用低剂量(75mg或160mg)阿司匹林,36070人未服用阿司匹林。两组患者随访的中位时间大体一致,为7.9年。不过,服用阿司匹林组平均年龄大于未服用组,并且有7955人患有冠状动脉疾病,11932人存在至少一种心血管疾病风险因素。
结果显示,服用低剂量阿司匹林组10年间肝细胞癌发生率为4.0%,未服用组为8.3%。排除其他致病因素,服用低剂量阿司匹林的患者患肝癌的相对风险降低了31%。但是对于阿司匹林的副作用,美国 MD 安德森胃肠病学、肝病学和营养学教授 Robert S. Bresalier 警告说:它有着非常显著的缺点——增加了内出血的风险,尤其是对于那些有饮酒习惯、有胃肠道溃疡病史或正在服用抗凝药的老年人。
服用阿司匹林能降低肝癌发生。DOI: 10.1056/NEJMoa1912035
这一试验结果是否足以证明阿司匹林能够预防肝癌?答案是否定的,这项研究也存在一些局限性,比如缺乏关于吸烟、乙型肝炎DNA水平、丙型肝炎发病率等方面的信息,同时受试者大多为白种人,缺乏关于实际发病率的数据,但是总体而言,这项研究揭示了阿司匹林对于帮助患有慢性病毒性肝炎患者预防肝癌的重要潜力,为肝癌的预防和治疗奠定了基础。
6、Lancet:阿特珠单抗用于早期三阴性乳腺癌的辅助化疗
乳腺癌主要有三个主要的类型,激素受体阳性、HER2阳性和阴性、三阴性。三阴性乳腺癌(TNBC)发病率占到乳腺癌总发病率的10%-20.8%,而且它的发病年龄比较小,好发于40岁以下、绝经之前的年轻女性。更要命的是,TNBC侵袭性强,极易发生远处转移已经局部位置的复发。
此外,TNBC的恶性程度更高。相较于其他类型的乳腺癌(五年生存率可以达到90%),如果能再早期诊断并治疗,TNBC五年生存率为77%。一旦确诊晚了,五年生存率会下降到14%。
目前,明确有效的治疗手段就是化疗。其中,早期TNBC患者的一线新辅助化疗方案包括蒽环类-环磷酰胺和紫杉烷类化疗。今年10月,来自麻萨诸塞州波士顿的癌症治疗中心的研究IMpassion031考察了阿特珠单抗联合白蛋白结合型紫杉醇-阿霉素-环磷酰胺作为早期TNBC的新辅助治疗方案的效果。相关结果发表在Lancet杂志上。
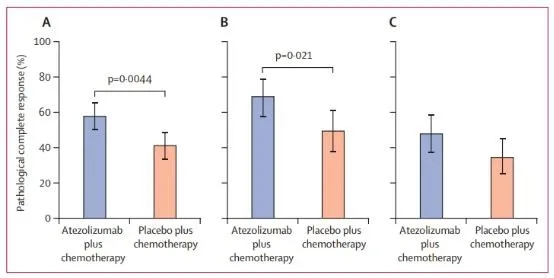
本次III期临床研究在13个国家的75个医疗中心开展,18岁以上的,未经治疗的II-III期TNBC患者参与,在白蛋白结合型紫杉醇(125mg/m 2,每周1次,持续12周)-阿霉素(60mg/m 2,每2周1次,持续8周)-环磷酰胺(600 mg/m 2,每2周1次,持续8周)治疗基础上,随机接受840mg阿特珠单抗或安慰剂,每2周1次。研究的主要终点为病理学完全反应。
共有333名患者参与研究,其中阿特珠单抗组165人,安慰剂组168人。阿特珠单抗组平均随访20.6个月,安慰剂组平均随访19.8个月。阿特珠单抗组95名患者实现组织病理学完全反应,安慰剂组为69人(58% vs 41%)。在PD-L1阳性亚组中,69%的阿特珠单抗组患者实现组织病理学完全反应,安慰剂组为49%。研究期间,阿特珠单抗组37名患者出现3-4级治疗相关严重不良事件,安慰剂组26例(23% vs 16%),各组均有1名患者出现5级不良事件。
阿特珠单抗联合白蛋白结合型紫杉醇-阿霉素-环磷酰胺治疗全随机人群、PD-L1阳性人群以及阴性人群的组织病理学反应。Doi: 10.1016/S0140-6736(20)31953-X.
研究认为,对于早期TNBC患者,阿特珠单抗-白蛋白结合型紫杉醇-阿霉素-环磷酰胺疗法可显著提高组织病理学响应。
7、NEJM双重磅:HERO & ARAMIS研究为前列腺癌患者药物治疗带来福音!
前列腺癌是男性第二大常见癌症,也是全球男性第五大癌症死亡原因。前列腺癌依赖于雄激素来促进肿瘤进展,消耗或阻断雄激素的激素疗法是治疗前列腺癌主要手段。尽管肿瘤最初对降低睾丸激素水平的药物或手术疗法敏感,但疾病进展通常是致命的。在过去的五年中,尽管转移性前列腺癌(mCRPC)患者的治疗手段取得了多项进步,但仍需要其他治疗方案来改善患者的临床结局,特别是那些在现有治疗中失败的患者或有禁忌症的患者。
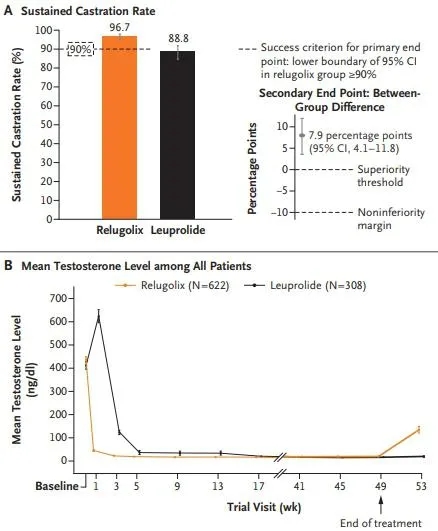
亮丙瑞林注射是治疗前列腺癌的标准药物,6月4日,国际HERO研究组发表在NEJM上的研究评估了口服促性腺激素释放激素拮抗剂Relugolix的疗效。
晚期前列腺癌患者参与本次III期临床研究,随机接受Relugolix(120毫克口服,每日一次)或亮丙瑞林 (每3个月注射一次),治疗48周。研究的主要终点是在48周内,持续的睾酮抑制(定义为睾酮含量<50ng/ml)。次要终点包括与主要终点相关的非劣效性、第4天阉割后的睾酮水平和第15天深度阉割后的水平(<20 ng/ml)。在一个亚组患者中评估睾酮恢复。
Relugolix或亮丙瑞林治疗有效率。doi: 10.1056/NEJMoa2004325.
共有622名患者接受Relugolix治疗,308名患者接受亮丙瑞林治疗。在接受Relugolix治疗的男性中,96.7%在48周内持续睾酮抑制阉割,而接受亮丙瑞林治疗的男性为88.8%,差异为7.9%。Relugolix组治疗后第4天睾酮抑制的患者百分比为56.0%,亮丙瑞林组为0%。停药90天后,Relugolix组的平均睾酮水平为288.4ng/ml,亮丙瑞林组为58.6ng/ml。主要心血管不良事件的发生率,Relugolix组为2.9%,亮丙瑞林组的6.2%。
研究认为,在晚期前列腺癌患者中,Relugolix能够快速、持续地抑制睾酮水平,其效果优于亮丙瑞林。
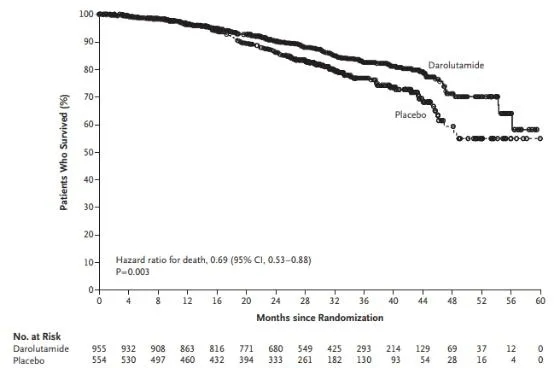
随后,9月9日,NEJM再次发表ARAMIS国际小组结果。研究显示,与安慰剂联合雄激素剥夺疗法相比,接受Nubeqa(darolutamide)联合ADT的非转移性去势抵抗性前列腺癌(nmCRPC)男性患者的总生存期(OS)得到显著提高(HR = 0.69),所有其他次要终点也得到显著改善。总体而言,不良事件发生率与单独雄激素剥夺疗法一致。
ARAMIS研究负责人Karim Fizazi博士说:“通过正在进行的研究,我们已经确定了将治疗重点放在延长nmCRPC男性寿命和减少副作用等方面”。
整体生存KM曲线。doi: 10.1056/NEJMoa2001342.
与安慰剂联合ADT相比,接受darolutamide联合雄激素剥夺疗法的男性表现出OS的显著改善,死亡风险降低了31%(HR = 0.69)。尽管安慰剂组中超过一半(56%)的患者(554名患者中的309名)在数据分析截止时(2019年11月15日)接受了后续的darolutamide或其他延长生命的治疗,但仍能观察到OS获益。
8、Nature:NLMT宣布肺癌精准治疗临床试验取得成功
7月15日,发表在Nature上的国家肺基质试验(NLMT)是世界上最大的针对NSCLC患者的精确医学临床试验,由英国癌症研究所(CRUK)资助,并得到慈善机构分层医学计划第2阶段(SMP2)筛选平台的支持。
NLMT与辉瑞(Pfizer)、阿斯利康(AstraZeneca)等制药公司合作,耗资2500万英镑。NLMT根据癌症的基因变化,为不同群体的患者匹配不同的治疗方案。在英国国家医疗服务体系(NHS)的支持下,NLMT强调下一波精准医学研究,特别是治疗基因组复杂癌症需要考虑的重要因素。
NLMT采用了创新式试验设计,结合了多种治疗手段。与传统临床试验相比,NLMT提供一种更加灵活和知情的方法,确保每一组单臂针对不同基因亚型的非小细胞肺癌的不同靶向治疗。该方法可以有效保证一旦新药和药物组合没有效果,就可以立即加入或轻易退出试验。
为此,SMP2对参加NLMT的患者进行基因筛查,以了解他们的肿瘤类型,以及他们是否具有与靶向治疗相匹配的相关基因特征。2015.05-2019.11期间,共招募288名患者进入19个靶向治疗组中。
但由于试验纳入的患者多在病程终末期,癌症进展使得许多患者过于不适而无法参加试验,因此试验损耗率很高,仅有5%的SMP2患者接受了NLMT治疗。此外,研究人员指出,靶向治疗试验应该在癌症征程中更早进行,并使用基于血液的基因组测试来快速转换患者与药物匹配所需的信息。
根据吸烟史和组织学表现,NLMT19个队列中目标病灶直径变化。doi: 10.1038/s41586-020-2481-8.
该研究的主要作者、伯明翰大学的医学肿瘤学家Gary Middleton教授说:"这项研究提供了如何设计下一波治疗复杂癌症的试验靶向疗法的数据。这是第一次用贝叶斯设计允许开放组群的结果数据与封闭组群的数据同时被报道,而以前的伞形研究只发表了完整组群的结果。
研究人员表示,NLMT是一个具有里程碑意义的复杂的创新设计实验,代表我们理解如何开发精密医学治疗癌症的挑战的重大改变。为此,英国癌症研究所的研究主任Ian Walker博士说:“NLMT是英国癌症研究的旗舰项目,继续为我们应该如何治疗基因多样性的癌症,如NSCLC提供重要的见解。它不仅将塑造未来研究提供复杂精准药物的思路,而且还展示了分子诊断测试和临床研究如何在英国全国卫生服务机构内以真正整合的方式工作,让患者获得最新的新疗法。”
下一步,NLMT将继续招募患者。一个新的联合臂刚刚加入到研究中,并在六月初开放。
9、Lancet:生活方式稍作改变,胃癌发生风险或能减半!
胃癌是我国第三大高发癌症。10月1日,来自来自南京医科大学和北京大学的团队合作建立了一个遗传风险分析模型,以评估胃癌高级因风险个体坚持健康生活方式的获益情况。相应结果发表在Lancet Oncology。
在该研究中,研究人员首先对6个独立的全基因组关联研究(GWAS)共包括21168名汉族人建立胃癌遗传风险模型建立,进行基因变异与胃癌的关联性分析。随后,将这些评分应用于一个全国性的前瞻队列中进行验证,该队列来自“中国慢性病前瞻性研究”(CKB),共对逾10万人进行了10年多的前瞻性随访;最后,通过上述参与者根据风险基因进行分层,计算胃癌发生与四个健康生活方式因素的相对和绝对风险,评估不同遗传风险人群健康生活方式与胃癌发生的关系。
其中,本文设定的健康生活方式分别是不吸烟(从未吸烟或戒烟时间>15年)、不饮酒(过去一年未饮酒或饮酒时间≤1个月)、少吃腌制食品(每周≤4天)及常吃新鲜蔬果(每周≥4天)。
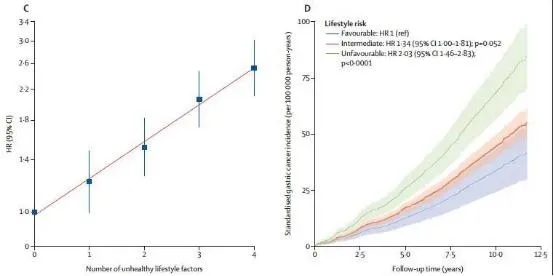
结果共发现112个与胃癌风险相关性最密切的单核苷酸多态性(SNP)。将该多基因风险进行分层并应用于CKB队列时,研究人员发现,随着基因风险增加,胃癌发生的相对风险显著上升。其中,与最低遗传风险的20%个体相比,具有中度遗传风险的人胃癌风险增加54%,而最高遗传风险的20%人群甚至增加108%!
接下来,研究人员进一步根据生活方式将CKB队列中的人群分为健康(同时符合上述健康生活因素4条,13.6%)、一般(符合2-3条,68.1%)以及不健康(符合0-1条,18.3%)三个层类。通过分析发现,遗传风险和生活方式对胃癌发生的影响相互独立但具有协同效应。相较于遗传风险低且采取健康生活方式,高遗传风险且生活方式不健康的参与者胃癌风险高5.14倍。在同一层类,即生活方式相似的人群也会随着遗传风险增加而增加。
胃癌风险随着不健康生活方式增加而升高。doi: 10.1016/S1470-2045(20)30460-5.
同时,胃癌发生的相对风险随着不健康生活方式的增加呈现明显的剂量依赖效应。与坚持健康生活方式的人相比,生活方式一般的人群胃癌风险增加34%,而不良生活方式更可增加达103%!更值得注意的是,具有高遗传风险的人群若采取上述四条健康的生活方式,胃癌的相对风险可降低53%,绝对风险更是可以降低112%!
由此可见,胃癌发生是多因素共同作用的结果,不仅与基因,更与生活方式相关。且不论自身基因是否具有优势,但只要采取2-3条健康的生活方式,就能较大程度降低非遗传层面的胃癌风险,从而避免胃癌发生。
宫颈癌是危及妇女生命健康的第二大杀手,仅次于乳腺癌,我国每年约有3.7万女性死于宫颈癌。HPV(人类乳头瘤病毒)是一类能引起皮肤乳头瘤样病变的病毒,目前已分离出100多种亚型,根据感染的组织部位和症状被分为低危型的和高危型,通常会导致尖锐湿疣和包括宫颈癌在内的多种癌症,其中宫颈癌是全世界导致妇女死亡的第二大癌症。
虽然已有研究表明四价HPV疫苗在预防高级宫颈病变中的疗效。但是,缺乏四价HPV疫苗接种与随后的浸润性宫颈癌风险之间关系的数据。10月1日,NEJM发表了瑞典隆德大学的研究,证实了四价HPV疫苗接种对降低浸润性宫颈癌风险的作用。
研究人员使用了瑞典全国人口统计和健康状况登记处,随访了2006年至2017年期间年龄在10至30岁之间的1672983名女孩和妇女。研究人员评估了HPV疫苗接种与浸润性宫颈癌风险之间的关联,从而调整了随访年龄、年份、居住县和父母特征,包括受教育程度、家庭收入、母亲出生国家和孕产妇疾病史。
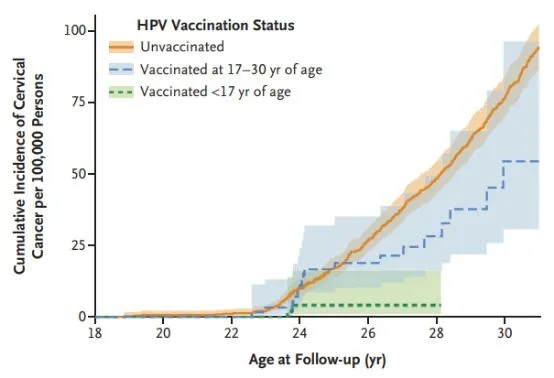
HPV疫苗接种后侵袭性宫颈癌的累积发生率。doi: 10.1056/NEJMoa1917338.
在研究期间,研究人员随访了女孩和妇女31岁是否患有宫颈癌。在接受四价HPV疫苗接种的19名妇女和未接受疫苗的538名妇女中诊断出宫颈癌。接种疫苗的妇女中,宫颈癌的累积发病率为每十万人中47人,未接种的妇女中每十万人中94人。调整随访年龄后,将接种人群与未接种人群进行比较宫颈癌的发生率比为0.51。在对其他协变量进行额外调整后,宫颈癌发生率比为0.37。在对所有协变量进行校正之后,在17岁之前接种疫苗的女性中,发生率比为0.12,而在年龄在17至30岁期间接种疫苗的女性中为0.47。
由此可见,在10至30岁的女孩和妇女中,四价HPV疫苗接种可大大降低浸润性宫颈癌的风险。